Las tecnologías para evitar el crecimiento de microorganismos en las superficies (como bacterias, virus e, incluso, hongos) existen desde hace mucho tiempo, pero la irrupción del SARS-CoV-2 que provoca la enfermedad del COVID-19, incrementó el interés por mecanismos que ayuden a prevenir la transmisión de enfermedades mediante el contacto con las superficies.
Antes de la aparición de este nuevo coronavirus, las superficies eran vistas solo como una parte de los muchos objetos con los que solíamos interactuar, hasta que la emergencia sanitaria disparó las alarmas sobre la posibilidad de contagio por contacto con ellas. Si bien esta vía de transmisión sigue siendo motivo de debate, un comunicado reciente de los CDC de Estados Unidos afirma que: “el riesgo de infección por SARS-CoV-2 a través de la ruta de transmisión de fomites es bajo, y generalmente menos de 1 en 10,000, lo que significa que cada contacto con una superficie contaminada tiene menos de 1 en 10,000 posibilidades de causar una infección”.¹
Contenido destacado
En este texto revisamos los principios y tecnologías que posibilitan la creación de recubrimientos con propiedades antimicrobianas y apuntamos los desarrollos que podrían dar forma a los recubrimientos antimicrobianos del futuro, que ayudarán a prevenir infecciones, especialmente en el ámbito médico.
Los recubrimientos antimicrobianos han sido explorados para su uso en distintas áreas de la medicina y, en particular, en los hospitales puesto que ahí tienen lugar las llamadas infecciones asociadas a la atención de la salud (IAAS). Desde antes de 2020 las IAAS eran motivo de preocupación en todo el mundo, ya que son la causa de diversas enfermedades que pueden provocar la muerte a cientos de miles de pacientes (las cifras son elusivas debido a diferencias en los registros de cada país o la falta de ellos). Además, las IAAS generan costos por miles de millones de dólares para las familias y los sistemas de salud.
Un documento de 2012 de la Organización Panamericana de la Salud (OPS)² señalaba que las encuestas nacionales de prevalencia de IAAS en varios países europeos, mostraban que estas infecciones “afectan, en promedio, a 1 de cada 20 pacientes hospitalizados, lo que corresponde a un total anual de 4.1 millones de pacientes”, de los cuales 37,000 podrían fallecer cada año en la Unión Europea.
En el caso del continente americano, los datos del sistema de salud canadiense señalaban que en ese país se contraían alrededor de 220,000 infecciones hospitalarias al año, que daban lugar a 8,000 muertes relacionadas con esa causa. Para Estados Unidos se calculaba que los costos médicos directos de las IAAS oscilaban entre 28.4 mil y 33.8 mil millones de dólares anuales, sin considerar los ajustes por el índice de precios de consumo.
El documento de la OPS agrega que, con frecuencia, “las IAAS son difíciles de tratar porque son causadas por microorganismos resistentes a los antibióticos”. Así, la prevención se presenta como el arma más poderosa para evitar este tipo de infecciones.
En 2018, el Instituto de Ciencia e Ingeniería Molecular (IMSE) del Imperial College de Londres reunió a un grupo de expertos a escala mundial en las áreas de ingeniería biomecánica, ingeniería de superficies, medicina, control de infecciones, gestión de enfermedades infecciosas y microbiología, con el fin de desarrollar nuevas soluciones de recubrimientos antimicrobianos para una gama de necesidades clínicas y de dispositivos médicos.
Como resultado de este proyecto, en marzo de 2020 se publicó el documento Smart surfaces to tackle infection and antimicrobial resistance, que evalúa el estado actual del desarrollo de superficies antimicrobianas para los entornos clínicos y los dispositivos médicos, y aborda la reducción de infecciones en el ámbito médico con ayuda de este tipo de superficies.
¿Qué es una superficie antimicrobiana?
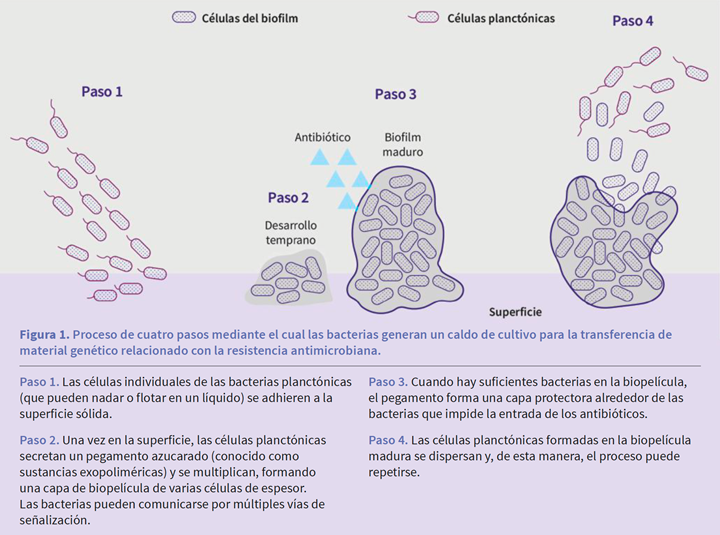
Antes de entrar a los mecanismos de acción de las superficies antimicrobianas hay que saber que las comunidades de materia que contienen los microbios se adhieren a las superficies formando biopelículas, que apoyan su supervivencia y persistencia en el ambiente, pues estas protegen a los microbios del ataque de biocidas y antibióticos.
Se ha demostrado que esas biopelículas desempeñan un papel clave en varias vías de infección, como en las relacionadas con dispositivos médicos (por ejemplo, en infecciones del tracto urinario asociadas a catéteres), infecciones relacionadas con prótesis (en articulaciones de la cadera infectadas) e infecciones transmitidas por el agua (en la contaminación del agua del hospital por pseudomonas y legionela). Ver la figura 1.
Se conocen como “superficies antimicrobianas” aquellas que tienen la capacidad de alterar los hábitos de los microorganismos al reducir su adherencia o al matar los microbios que ya se han adherido a la superficie.
Todas las ilustraciones de este artículo provienen del documento Smart surfaces to tackle infection and antimicrobial resistance, publicado por el Instituto de Ciencia e Ingeniería Molecular (IMSE) del Imperial College de Londres, y fueron traducidas y publicadas con su permiso.
Enfoques para crear superficies antimicrobianas
De acuerdo con los expertos del IMSE, existen tres enfoques principales para generar superficies antimicrobianas, a saber:
1. Cambiar la topografía de la superficie. Alterar las propiedades físicas de una superficie para hacerla menos capaz de soportar la contaminación y más fácil de limpiar.
2. Agentes antimicrobianos incorporados de lenta liberación. Fabricar de forma permanente un agente con actividad antimicrobiana, por ejemplo, que sea una propiedad intrínseca de alguna superficie metálica, o una superficie que se diseñe con agentes antimicrobianos que se liberen gradualmente.
3. Superficies autolimpiables y de autopulido. Por lo general, estos métodos se basan en un líquido que elimina periódicamente la capa exterior del recubrimiento en una superficie que se reemplazará con una capa subyacente no contaminada.
Alterar la topografía de las superficies
Para cambiar la topografía de una superficie es posible alterar sus propiedades mediante dos aplicaciones: ya sea para volverla antimicrobiana (al disminuir la viabilidad de los microbios asociados a la superficie) o convertirla en antiadhesiva (al reducir la capacidad de los microbios para adherirse). Estas dos soluciones suelen evitar el uso de productos químicos antibacterianos y son seguras para los seres humanos.
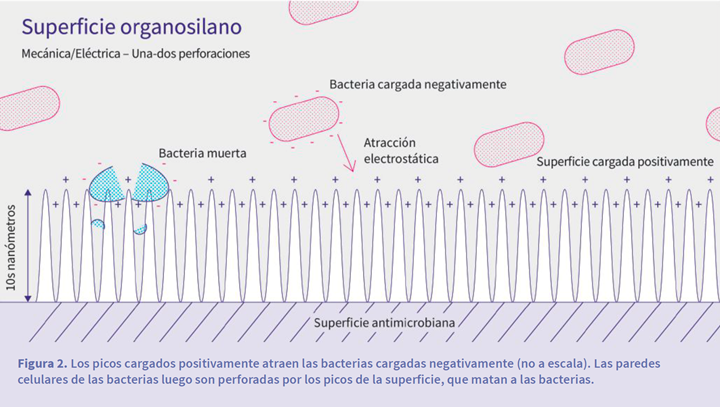
Un ejemplo de este tipo de superficies se inspira en las alas de las cigarras, cuyas alas tienen propiedades antimicrobianas. La observación a nanoescala muestra que la superficie de las alas de estos insectos tiene picos que pueden perforar las paredes celulares de las bacterias. Se ha demostrado que estos picos son muy efectivos contra ciertas bacterias, incluidas Escherichia coli y Pseudomonas aeruginosa (que son Gram-negativas), pero no combaten los Bacillus subtilis ni el Staphylococcus aureus (que son Gram-positivos).
Se cree que esta selectividad se debe a diferencias entre las paredes celulares de diferentes tipos de bacterias; por ejemplo, Bacillus subtilis y Staphylococcus aureus tienen paredes celulares más rígidas y, por lo tanto, presentan un menor riesgo de que sus paredes celulares sean perforadas por los picos de la superficie.
Con base en estas observaciones, recientemente se crearon superficies con picos nanométricos que utilizan una estructura metalorgánica (ver figura 2). Estas superficies están cargadas positivamente, lo que atrae a las bacterias (por lo general cargadas negativamente) a la superficie y ahí son perforadas.
En cuanto a las superficies antiadhesivas, cuando se altera la estructura de una superficie a nivel nanométrico para hacerla ondulada, por ejemplo, se produce una reducción en la adhesión microbiana. “Al igual que con otras metodologías de manipulación de superficies, los resultados dependen de la aplicación”, señala el documento del IMSE.
Muchas superficies antiadhesivas utilizan una rugosidad superficial muy fina, pero se ha demostrado que las superficies de entre 1 y 100 mm reclutan y retienen a los microbios, mientras que la introducción de rugosidad a microescala (1 a ≤ 1000 μm) disminuye la adherencia microbiana. Esto ha llevado a recomendar el desarrollo de materiales con topografías de múltiples escalas de longitud, ya que podrían limitar los agentes bioincrustantes a escalas de longitud macro, micro y, posiblemente, nano.
Un excelente ejemplo de superficie antiadhesiva es la tecnología Sharklet™ que imita tanto la topografía como la geometría de la piel de los tiburones para hacer que la superficie sea antiadhesiva. Esta alteración ha permitido reducir la contaminación de superficie con Staphylococcus aureus y del Staphylococcus aureus resistente a los antimicrobianos entre 97 y 94%, respectivamente. De igual forma, esta tecnología se ha utilizado para limitar la propagación de microbios en los tubos de catéter y ha demostrado ser muy efectiva para reducir la presencia de Escherichia coli y Staphylococcus aureus.
Agentes antimicrobianos de lenta liberación incorporados a la superficie
Las superficies antimicrobianas de cobre o aleaciones de cobre, como el latón o el bronce, cuentan con una capacidad natural para matar las bacterias rápidamente y se usan en la gran mayoría de recubrimientos antimicrobianos comerciales. Estas aleaciones son quizás la opción más conocida de superficies antimicrobianas, ya que han demostrado su actividad in vitro contra una variedad de patógenos y son efectivas para reducir las infecciones asociadas con la atención médica.
La figura 3 muestra que el uso de estas superficies se basa en la producción de iones de cobre (Cu2 +) que se considera la especie antimicrobiana predominante.
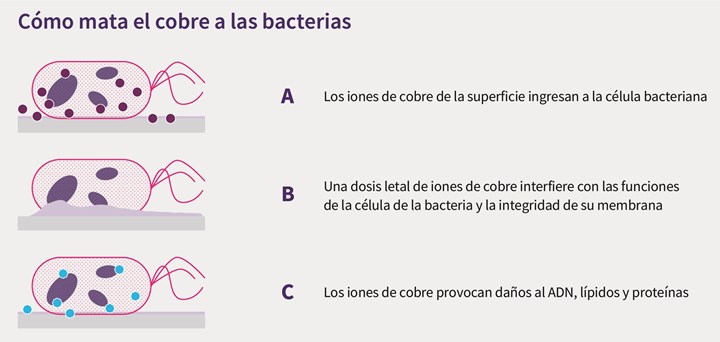
Figura 3. Mecanismo por el cual las bacterias mueren en las superficies de cobre.
La Agencia de Protección Ambiental (EPA), de Estados Unidos, encontró que las aleaciones de cobre matan más del 99.9% de las bacterias que causan enfermedades, en dos horas; sin embargo, esto requería una limpieza regular como requisito previo para su efectividad. La seguridad, durabilidad, aceptabilidad y rentabilidad a largo plazo del uso de aleaciones de cobre como superficies antimicrobianas no se ha evaluado formalmente.

En febrero de este año, EPA anunció que las aleaciones de cobre que contienen al menos 95.6% de este material brindan una protección efectiva a largo plazo contra diversos virus, incluido el SARS-CoV-2, que causa el COVID-19, e inscribió a este material como antimicrobiano para favorecer la salud pública.
La plata es otro material que puede liberar iones al contacto con el aire, lo que ayuda a prevenir la replicación del ADN y evitar la resistencia de los patógenos. Diversos estudios han mostrado que la plata es tóxica para una amplia gama de patógenos, pero el alto costo restringe su uso a aplicaciones que requieran concentraciones muy pequeñas. La presencia de nanopartículas de plata ha mostrado su eficacia como bactericida, de acuerdo con el doctor Atul Tiwari, pero el costo de este material sigue limitando su uso.
Uno de los usos más comunes del cobre es su aplicación en superficies de contacto para los entornos clínicos, como las barandillas de las camas o las perillas de las puertas, lo que puede reducir la carga de contaminación del entorno cercano al paciente y disminuir el riesgo de transmisión. No obstante, al igual que la plata, el costo del cobre complica su uso generalizado.
El doctor Tiwari señala que los materiales hechos a base de grafeno también contienen materiales antimicrobianos como fullerenos, grafito, óxidos de grafeno y óxidos de grafito, que pueden afectar el crecimiento de microbios debido a que alteran la membrana bacteriana, el estrés oxidativo y la adherencia de los microorganismos, pero al igual que la plata y el cobre, su costo impide que se utilice de forma generalizada.
Superficies autolimpiables y de autopulido
Las superficies fotocatalíticas son un ejemplo de superficies autolimpiables por su capacidad para absorber la luz y pasar la energía a otras moléculas. Algunas de las superficies más usadas de este tipo contienen dióxido de titanio (TiO2), un material que no es tóxico, además de ser barato y abundante.
Cuando el dióxido de titanio absorbe luz a cierta longitud de onda en agua y oxígeno, se produce un radical libre de hidroxilo, una molécula con un electrón desapareado. Dado que los radicales libres de hidroxilo son muy reactivos, matan las bacterias al atacar su membrana celular.
Las superficies fotocatalíticas son muy eficientes porque su efecto biocida autorregenerante permite que se mantengan activas por largos periodos. El dióxido de titanio ha mostrado su efectividad como recubrimiento antimicrobiano en superficies como las baldosas de cerámica y las ventanas autolimpiables de los hospitales.
Por otro lado, las tecnologías de autopulido tienen propiedades antiincrustantes, muy útiles cuando se aplican en el exterior de los cascos de los barcos. Esta aplicación se ha vuelto popular en los últimos años, a medida que las nuevas regulaciones prohíben o restringen el uso de pinturas tóxicas en el exterior de los barcos. La mayoría de estos sistemas de pintura “sin estaño” utilizan pigmentos solubles en el agua de mar, como los óxidos de cobre (Cu2O, CuO). La capa superficial del recubrimiento se rompe con el agua, lo que libera un biocida y la constante erosión de la superficie da como resultado la exposición de biocidas frescos.
El futuro: las superficies antimicrobianas
Como se ha mostrado, las superficies antimicrobianas tienen un gran potencial para reducir la adherencia de los microorganismos, matar bacterias, interrumpir el hábitat microbiano y hacer que las superficies sean más fáciles de limpiar. Todo esto contribuye a reducir el riesgo de infección por bacterias, tanto en los hospitales como en las superficies de los dispositivos médicos donde se apliquen, y transformaría los entornos de salud al ayudar a prevenir la propagación de infecciones en pacientes vulnerables, como las personas adultas mayores y los recién nacidos que requieren cuidados intensivos.

El epidemiólogo Jonathan Otter del Imperial College de Londres durante la presentación del documento Smart Surfaces en marzo de 2020.
De igual forma, las superficies antimicrobianas podrían hacer que los sistemas de agua de los hospitales sean menos propensos a la contaminación con bacterias como pseudomonas y legionela.
No obstante, como señala el documento del IMSE, cada superficie antimicrobiana “tiene sus propios puntos fuertes y débiles, según la aplicación o la infección de que se trate”. Esto significa que la propagación de infecciones y la resistencia antimicrobiana “no puede abordarse solo mediante tecnologías de superficie antimicrobianas”, sino que esta clase de tecnologías deben ser parte de un abordaje más amplio, que involucre al personal clínico y de limpieza, y que contemple un uso responsable de antibióticos, que son los principales culpables de la resistencia antimicrobiana.
Los expertos reunidos por el IMSE señalan que para sacar provecho de los beneficios que pueden brindar estas superficies innovadoras se requieren más estudios que midan su impacto en las infecciones, la resistencia a los antimicrobianos y su impacto ambiental. De igual forma, es necesario seguir investigando las superficies antimicrobianas en entornos de ingresos bajos y medios, donde podrían disminuir el impacto de algunos problemas como la falta de agua potable y fuentes confiables de energía.
El grupo de especialistas reunido por el Imperial College de Londres subraya la necesidad de abordajes multidisciplinarios con especialistas en física, química, ingeniería y medicina, con el fin de avanzar en la creación de soluciones para las superficies y favorecer la innovación en este terreno, así como el desarrollo de nuevos productos que puedan llegar al mercado lo antes posible.
¹ Science Brief: SARS-CoV-2 and Surface (Fomite) Transmission for Indoor Community Environments, Centers for Desease Control and Prevention, actualizado el 5 de abril de 2021.
² Vigilancia epidemiológica de las infecciones asociadas a la atención de la salud. Módulo III – Información para gerentes y directivos, OPS, Washington, D.C., 2012.
CONTENIDO RELACIONADO
-
Inicia estudio clínico sobre tecnología de recubrimiento de plata para tratar fracturas
Aap Implantate AG anunció el inicio de un estudio clínico sobre su tecnología de recubrimiento de plata antibacteriana que se podría usar en placas anatómicas y tornillos para tratar fracturas de hueso en humanos.
-
Descubren novedoso grafeno repelente al agua
Un descubrimiento inesperado por parte de un grupo de investigadores abre la posibilidad de crear recubrimientos superhidrofóbicos a partir del grafeno. Estos recubrimientos podrían tener aplicaciones en diversas industrias.
-
Recubrimiento antimicrobiano para implantes ortopédicos previene infecciones peligrosas
La mezcla de polímeros autoensamblables y antibióticos en implantes de cadera intramedulares humanos se cura utilizando una fuente de luz de mano.